To calculate result you have to disable your ad blocker first.
Balancear Ecuaciones Quimicas
Para equilibrar la ecuación química, ingrese la ecuación y el valor. presione el botón calcular usando el balanceador de ecuaciones químicas
Balanceador de ecuaciones químicas
El balanceador de ecuaciones químicas ayuda a mantener el equilibrio en ambos lados de la ecuación. La calculadora viene con la tabla periódica completa, lo que hace que reconocer e ingresar diferentes elementos sea muy fácil.
Cómo utilizar esta herramienta?
Para utilizar el balanceador de ecuaciones químicas, siga estos pasos.
- Introduce los elementos de la ecuación.
- Suma los coeficientes.
- Hacer clic Calcular .
Puede hacer clic en cualquier elemento de la tabla periódica para ingresarlo o escribir el elemento usted mismo.
¿Qué es una ecuación química desequilibrada?
A ecuacion quimica representa una reacción química con la ayuda de símbolos de los elementos utilizados en la reacción.
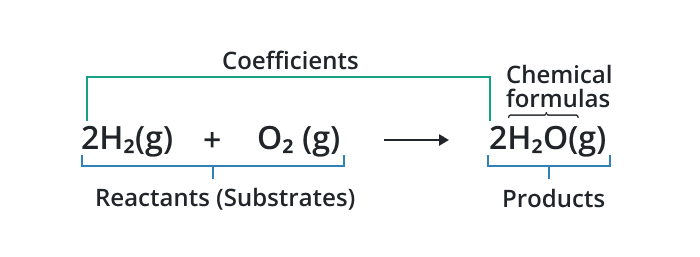
Una ecuación química desequilibrada se caracteriza por un número desigual de átomos en el lado del reactivo en comparación con el lado del producto. Por ejemplo, considere la ecuación desequilibrada para la combustión de metano:
CH₄ + O₂] CO₂ + H₂O
En esta ecuación, el número de átomos de cada elemento no está equilibrado. En el lado izquierdo, hay un carbono ( C ) átomo y cuatro hidrógeno ( h ) átomos, mientras que en el lado derecho, hay un carbono ( C ) átomo y solo dos hidrógeno ( h ) átomos.
De manera similar, en el lado izquierdo, hay dos oxígeno ( oh ) átomos, pero en el lado derecho, hay tres oxígeno ( oh ) átomos.
Estas ecuaciones van en contra de la ley de conservación de la masa, según la cual la materia sólo puede cambiar. No puede ser creado ni destruido.
¿Cómo equilibrar las ecuaciones químicas?
Para satisfacer la ley de conservación de la masa y obtener una ecuación equilibrada, se deben ajustar los coeficientes para garantizar que el número de átomos de cada elemento sea el mismo en ambos lados.
Aquí hay una guía general paso a paso sobre el equilibrio de ecuaciones químicas con ejemplos.
Paso 1: Escribe la ecuación no balanceada:
Comience escribiendo la ecuación química tal como está, sin ningún coeficiente. Por ejemplo, consideremos la combustión de metano:
CH₄ + O₂] CO₂ + H₂O
Paso 2: Cuente el número de átomos de cada elemento:
Examina cada elemento de la ecuación y cuenta el número de átomos en ambos lados. Haz un recuento de cada elemento:
Carbono (C): 1 a la izquierda, 1 A la derecha
Hidrógeno (H): 4 a la izquierda, 2 A la derecha
Oxígeno (O): 2 a la izquierda, 3 A la derecha
Paso 3: Comienza con el elemento más complejo o abundante:
Comience a equilibrar la ecuación ajustando los coeficientes de los elementos que aparecen en la menor cantidad de lugares o que tienen los valores de coeficiente más altos. En este ejemplo, comience con oxígeno ( oh ), ya que aparece en un solo compuesto en cada lado.
Etapa 4: Use coeficientes para equilibrar los átomos:
Agrega coeficientes a las fórmulas de los compuestos para equilibrar el número de átomos de cada elemento en ambos lados. Para equilibrar los átomos de oxígeno, agregue 2 como coeficiente frente al agua ( H₂O ):
CH₄ + O₂] CO₂ + 2H₂O
Paso 5: Cuente el número de átomos de cada elemento:
Después de sumar los coeficientes, vuelva a verificar la cantidad de átomos de cada elemento en ambos lados de la ecuación:
Carbono (C): 1 a la izquierda, 1 A la derecha
Hidrógeno (H): 4 a la izquierda, 4 A la derecha
Oxígeno (O): 4 a la izquierda, 4 A la derecha
Paso 6: Continuar equilibrando:
Si la ecuación todavía está desequilibrada, repita los pasos 3 a 5 , centrándose en otros elementos que requieren equilibrio. En este ejemplo, el carbono ( C ) e hidrógeno ( h ) ya están equilibrados, así que continúe para equilibrar el oxígeno ( oh ) en este caso.
Para equilibrar los átomos de oxígeno restantes, coloque un coeficiente de 2 frente al oxígeno ( O₂ ) molécula:
CH₄ + 2O₂ → CO₂ + 2H₂O
Paso 7: Verifique la ecuación final:
Una vez que todos los átomos estén equilibrados, vuelva a verificar que la ecuación esté completamente equilibrada, asegurándose de que el número de átomos de cada elemento sea igual en ambos lados:
Carbono (c): 1 a la izquierda, 1 A la derecha
Hidrógeno (H): 4 a la izquierda, 4 A la derecha
Oxígeno (O): 4 a la izquierda, 4 A la derecha
¿Cómo equilibrar ecuaciones químicas utilizando el método del número de oxidación?
Equilibrar ecuaciones químicas utilizando el método del número de oxidación implica asignar números de oxidación a los elementos de los reactivos y productos y luego utilizar los cambios en los números de oxidación para equilibrar la ecuación.
Aquí hay una guía paso a paso sobre cómo equilibrar ecuaciones químicas usando el método del número de oxidación:
Paso 1: Escribe la ecuación no balanceada:
Considere la reacción entre el permanganato de potasio ( KMnO₄ ) y hierro( II ) sulfato ( FeSO₄ ) para formar manganeso ( II ) sulfato ( MnSO₄ ), sulfato de hierro (III) ( Fe₂(SO₄)₃ ), y sulfato de potasio ( K₂SO₄ ):
KMnO4 + FeSO4 > MnSO + Fe(SO) + K4
Paso 2: Asigne números de oxidación:
Los números de oxidación son cargas teóricas asignadas a átomos individuales dentro de un compuesto, determinadas por un conjunto específico de pautas o reglas.
- KMnO₄: K tiene un número de oxidación +1, Mn tiene un número de oxidación +7 y cada oxígeno (O) tiene un número de oxidación -2.
- FeSO₄: Fe tiene un número de oxidación de +2, S tiene un número de oxidación de +6 y cada oxígeno (O) tiene un número de oxidación -2.
- MnSO₄: Mn tiene un número de oxidación +2, S tiene un número de oxidación +6 y cada oxígeno (O) tiene un número de oxidación -2.
- Fe₂(SO₄)₃: El Fe tiene un número de oxidación +3, el S tiene un número de oxidación +6 y cada oxígeno (O) tiene un número de oxidación -2.
- K₂SO₄: K tiene un número de oxidación +1, S tiene un número de oxidación +6 y cada oxígeno (O) tiene un número de oxidación -2.
Paso 3: Identifique los elementos que sufren oxidación y reducción:
El elemento que experimenta un aumento en su número de oxidación se está oxidando, mientras que el elemento que sufre una disminución en su número de oxidación se está reduciendo.
En este ejemplo, el estado de oxidación de Minnesota en KMnO₄ cambios de +7 a +2 , indicando reducción. El estado de oxidación del Fe en Archivado cambios de +2 a +3 , indicando oxidación.
Etapa 4: Equilibra los átomos en proceso de oxidación y reducción:
En este caso colocamos un coeficiente de 5 delante de FeSO₄ para equilibrar el número de fe átomos en ambos lados.
KMnOr + 5FeSOr > MnSO + Fe(SO) + K4
Paso 5: Equilibra los átomos restantes:
Coeficientes de lugar de 8 , 1 , y 10 delante de KMnO₄ , MnSO₄, y K₂SO₄ , respectivamente, para equilibrar los átomos restantes.
8KMnO + 5FeSOr > 8MnSO + Fe(SO) + 10KSO
Paso 6: Verificar el saldo:
Vuelve a verificar que el número de átomos de cada elemento sea el mismo en ambos lados de la ecuación. Además, asegúrese de que las cargas estén equilibradas para cualquier especie cargada presente.
Paso 7: Ajuste los coeficientes según sea necesario:
Si la ecuación aún no está balanceada, regrese y ajuste los coeficientes según sea necesario hasta lograr una ecuación balanceada.
En este ejemplo, la ecuación final balanceada para la reacción es:
8KMnO + 5FeSOr > 8MnSO + Fe(SO) + 10KSO

